Rintasyöpä, ylipaino, vuorokausirytmin häiriö ja leptiiniresistenssi
Voi pojat. Tarkoituksenani oli kirjoittaa kattava postaus D-vitamiinista, mutta niin vain kirjoitus muuttuikin käsittelemään rintasyöpää. Osin siksi, että satuin törmäämään Instagramissa Terapeutti...
Villen postaukseen terveydenhuollon tilasta ja siihen menevistä kansantalouden varoista liittyen mm. rintasyövän hoitoon. Jaoin tästä stooreja omalla instagram tililläni ja sainkin monia vihaisia viestejä siitä, että loukkaan rintasyöpä-potilaita, tai terveellisten elintapojen perään kuuluttaminen on rikollista.
Mitä sitten Terapeutti Villen IG-postaus sitten käsitteli ja mitä informaatiota Ville siitä jakoi? Villen lähestyminen aiheeseen on enemmän poliittinen ja yksityistyvää terveydenhuoltoa vastustava, jos osasin tulkita tätä hänen tarkoitusperäänsä oikein.
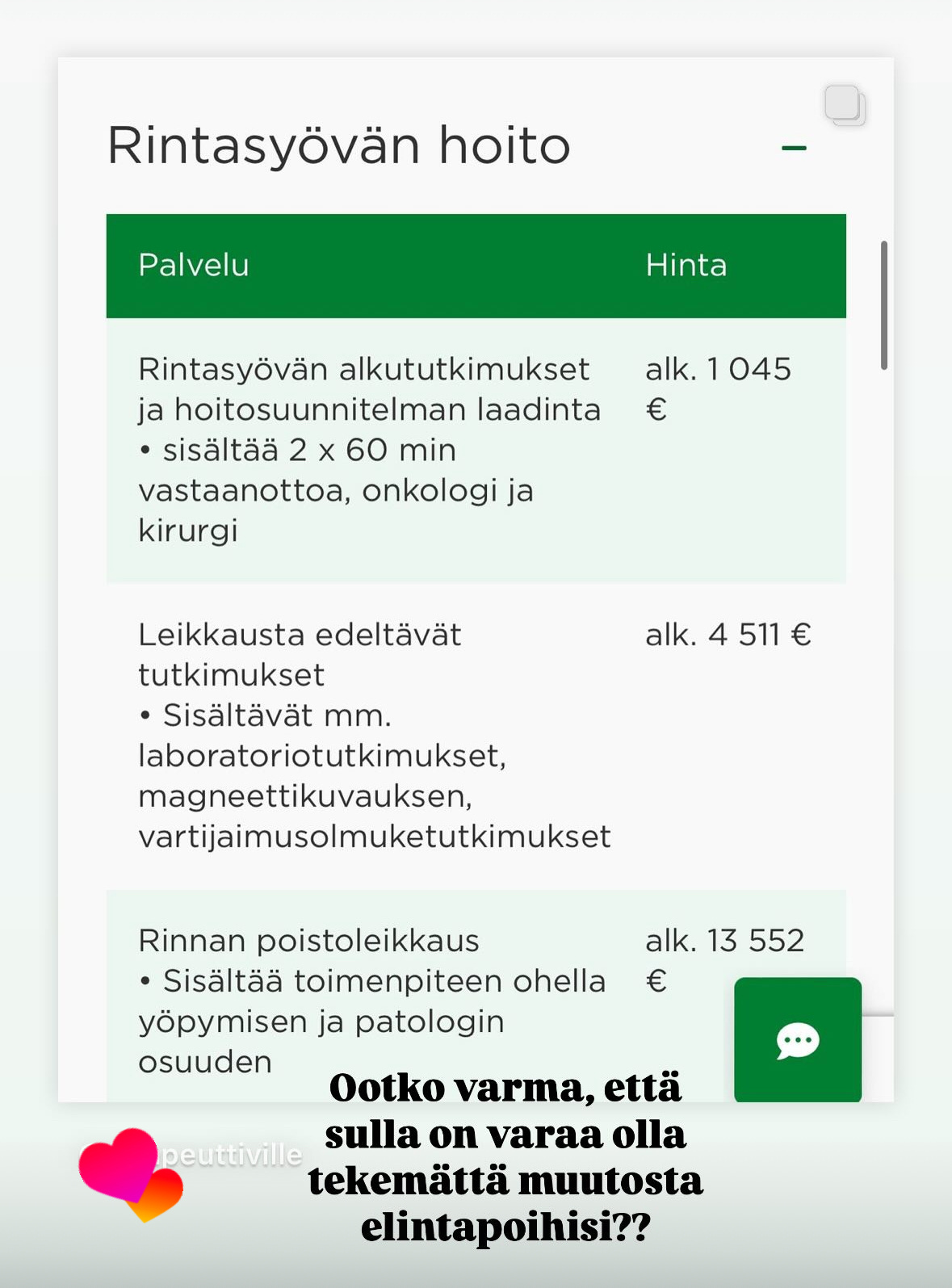
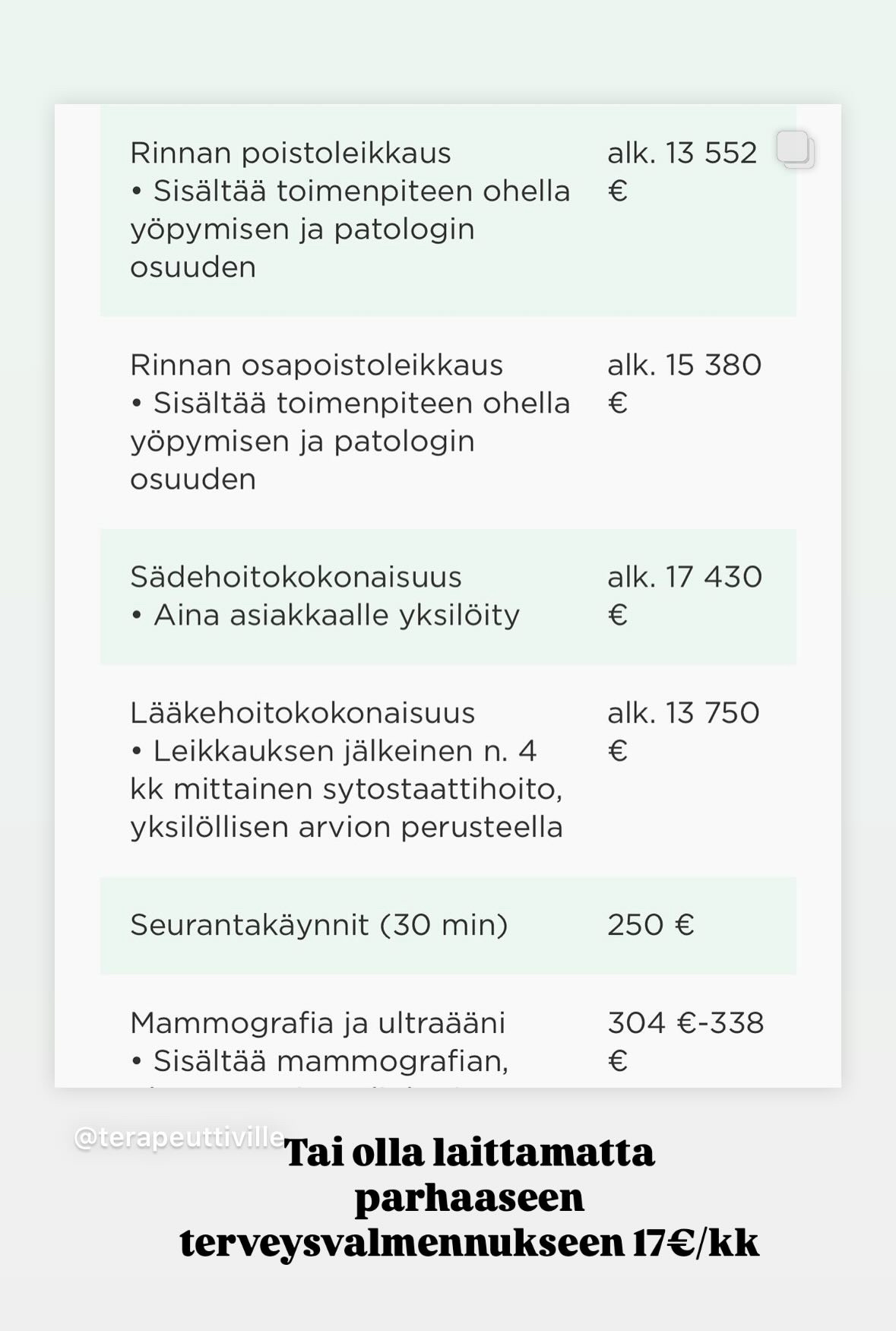
Oma huomioni kuitenkin kiinnittyi Mehiläisen tarjoamiin palveluihin rintasyöpäpotilaille ja niiden kustannuksiin.
Onhan ne kalliita ja suuri osa kuitenkin hakeutuu syöpätapauksissa kunnalliseen perusterveydenhuollon hoitoon ja se on toki edullisempaa kuin yksityisen terveydenhuollon palvelut.
Jaoin kuitenkin kustannuksista omiin stooreihini, kommentilla: että onko sinulla varaa olla tekemättä elämäntapamuutosta? Tämän tarkoitus oli lähinnä siinä, että jos rintasyöpään sairastuminen tapahtuu ja hoitoa saa näillä hinnoilla niin kumpi on sitten todellisuudessa kalliimpaa? Ennakoiva terveydenhuolto vai sairastumisen hoito.
Kyllä, tiedän että kunnallisella puolella hoito ei maksa “mitään”, mutta jos katsoo kunnallisen terveydenhuollon tilaa, jonoja yms. niin kaikki eivät välttämättä saa sitä hoitoa ja paljon on ollut keskustelua ja esimerkkejä siitä, ettei hoidon laatu välttämättä vastaa toivottua lopputulosta.
Toinen asia on tietysti rinta-ja kaikkien muidenkin syöpien räjähdysmäinen kasvu. Jos terveydenhuolto on jo kuormittunut tällä hetkellä ja tulevina aikoina meitä odottaa “syöpätsunami” ja turbosyövät, niin miten voi olla rikollista jos peräänkuuluttaa terveiden elintapojen perään? Koska ihan tutkitusti niillä voi vaikuttaa siihen omaan terveyteen. Myös syöpä-alttiuteen.
Totta on tietysti geneettinen riski, mutta nekään eivät aina automaattisesti tarkoita, että ne ovat määrätty ja kiveen kirjoitettu sinne sinun kohtaloosi. Vaan, kuten olen aiemminkin sanonut: Geenit ovat ladattu ase käsissäsi ja elintavat vetävät liipasimesta.
Lihavuus on rintasyövän yksi riskitekijä
Kiistattomasti! Minun puolestani voitte tunkea roosa-nauhanne sinne minne aurinko ei paista. Niillä ei paranneta tai ehkäistä syöpää. Etenkin, jos roosa-nauhaa kampanjoidaan asioilla, jotka aiheuttavat esimerkiksi sitä lihavuutta, joka on riskitekijä rintasyövälle.
Tästä päästäänkin kirjoituksen varsinaiseen aiheeseen. Miksi sanoin sen mitä sanoin? Miksi moni odottaa vakavaa sairautta ennen kuin tekee asialle tai omalle riskialttiudelleen jotain?
Tai mikset tekisi? Jos vastustat ajatusta elintapojen muuttamisesta liian kalliina tai hankalana. Sinun pitää olla valmis valitsemaan vaikeutesi. Onko tosissaan kallista hankkia esim. alle 20€ kuukaudessa maksava valmennus, joka auttaa sinut eroon ylipainosta ja lihavuudesta ilman lääkityksiä, pistoksia tai leikkauksia?
Oletko sitten sairastuttuasi valmis laittaamaan kymmeniä tuhansia hoitoihin, jotka eivät nekään välttämättä pelasta sinua kuolemalta?
Jos et vielä tunne minua tai aiheita joista puhun ja miten mistäkin puhun, voit kokea nämä sanani pöyristyttävinä tai vaikka loukkaantua, kun en juurikaan filtteröi mitä sanon. Sorry, not sorry.
Kun puhun lihavuudesta ja ylipainosta, puhun suoraan. Aivan kuten tämä aineenvaihdunnalien kriisin aikana tuleekin. Eikä hyssytellä ongelmaa kehopositiivisuuden varjolla, sillä kukaan ei voi kieltää etteikö lihavuudella olisi terveysriskejä ja etteikö se altistaisi vakaville sairauksille. Joten minusta on suorastaan rikollista olla nostamatta tätä kissaa pöydälle ja katsoa rohkeasti sen kissan hännän alle ja todeta tuijottavansa päin persettä olevaa kansanterveydellistä tilannetta.
Elintavat vaikuttavat lihavuuteen ja ylipainon manifestoitumiseen
Ylipaino ja lihavuus on elintapojen ja ympäristön vaikutuksen seurausta. Jos koet, että tämä on sairastuneen syyllistämistä, sitä se ei tietenkään ole. Sairastunut ei vaan ole kenties ollut tietoinen kaikista niistä asioista, jotka vaikuttavat alttiuteen sairastua esimerkiksi siihen rintasyöpään. Jos et tiedä asiasta, et voi myöskään tehdä päätöksiä informatiivisesta paikasta. Joten älä ammu viestintuojaa.
Miksi olen sitä mieltä, että ylipaino-pandemialle pitää tehdä jotain ERILAISTA kuin olemme tähän asti tehneet?
Siksi, koska vanhat keinot eivät selkeästikään toimi. Jos vähemmän syöminen ja enemmän liikkuminen olisi ainoa avain saavuttaa normaalipaino, tätä ongelmaa ei olisi. Olisimme kaikki onnistuneet, eikä elintapa-sairaudet riivaisi meitä, kuten nykypäivänä. Joten obviously, meidän tarvii laajentaa näkövinkkeliä mistä tarkastelemme asiaa.
Syyttävä sormeni osoittaa ruokateollisuutta kohtaan kyllä, sillä markkinointi- insentiivikoneisto on vallan kahvassa, lääketeollisuuden kanssa käsi kädessä.
No, puhutaanpas siitä rintasyövästä lisää ja minkälaisin mekanismein ylipaino ja lihavuus altistaa siihen sairastumista.
Rasvakudoksen merkitys
Meillä ihmisillä on kolmea erilaista rasvakudosta. Meiltä löytyy valkoista rasakudosta (WAP= White Adipose Tissue) sekä ruskeaa rasvakudosta (Brown Adipose Tissue= BAT) Kolmas rasvakudoksemme on beigeä rasvakudosta (bWAT).
Valkoista rasvakudosta meistä löytyy eniten ja sen määrä näkyy kehossamme sinä tuttuna läskinä. Mutta se on paljon muutakin kuin vain läskiä. Valkoisella rasvakudoksella on oma endokriininen järjestelmä. Suomeksi sanottuna, se tarkoittaa sitä että tämä rasvakudos erittää ja valmistaa hormoneita ja mm. tulehdusvälittäjä-aineita.
Lihavuus voi lisätä kroonista matala-asteista tulehdusta kehossa, erityisesti valkoisessa rasvakudoksessa, jota löytyy esimerkiksi vatsan alueelta ja rintakudoksesta. Tämä tulehdustila voi häiritä immuunijärjestelmän toimintaa, aiheuttaen esimerkiksi tulehdusta edistävien sytokiinien määrän kasvua ja T-solujen heikentynyttä toimintaa, jotka ovat tärkeitä immuunipuolustuksen osia.
Rintakudoksen ollessa suurimmaksi osaksi valkoista rasvakudosta, lihavuuden aiheuttama tulehdus ja rasvakudoksen muutokset voivat suoraan vaikuttaa rintasyövän kehittymiseen. Syöpäsolut voivat hyötyä lihavuuden aiheuttamasta tulehdustilasta ja rasvakudoksen muutoksista, mikä voi nopeuttaa syövän kasvua ja leviämistä.
Rintasyövän epidemilogia
Rintasyövän diagnosoinnissa ja hoidossa syöpä jaotellaan erilaisiin alatyyppeihin sen perusteella, mitkä reseptorit löytyvät syöpäsoluista. Tämä auttaa lääkäreitä suunnittelemaan hoitoa tarkemmin, sillä eri syöpätyypit reagoivat erilaisiin hoitoihin.
Luminaaliset kasvaimet (ER ja/tai PR ja mahdollisesti HER2) ovat yleisin rintasyövän tyyppi, ja niitä voidaan usein hoitaa hormoniterapialla, joka kohdistuu estrogeeniin tai progesteroniin.
HER2-positiivinen rintasyöpä on kasvaintyyppi, jossa HER2-reseptori on yliekspressoitu. Nämä kasvaimet voidaan hoitaa lääkkeillä, jotka kohdistuvat HER2-reseptoriin.
Kolminkertaisesti negatiivinen rintasyöpä (TNBC) on rintasyövän aggressiivisempi muoto, koska siinä ei ole ER-, PR- eikä HER2-reseptoreita, mikä tekee siitä vaikeammin hoidettavan. TNBC ei reagoi hormoniterapioihin tai HER2-kohdennettuihin hoitoihin, joten sen hoitovaihtoehdot ovat rajatummat, ja se vaatii usein kemoterapiaa.
Lihavilla rintasyöpäpotilailla on yleensä suurempia kasvaimia diagnoosivaiheessa, tutkimusten mukaan sekä suurempi riski syövän leviämistä imusolmukkeisiin ja etäpesäkkeisiin sekä heikompi ennuste verrattuna normaalipainoisiin potilaisiin. Lisäksi lihavilla potilailla on suurempi todennäköisyys syövän uusiutumiseen.
Ylipainon vaikutukset rintasyöpään selittyvät osittain biologisilla tekijöillä, kuten kroonisella matala-asteisella tulehduksella ja aineenvaihdunnan häiriöillä, jotka voivat pahentaa syövän etenemistä. Myös vyötärön alueen lihavuus, joka liittyy metaboliseen oireyhtymään, lisää riskiä syövän uusiutumiselle ja heikentää hoitotuloksia.
Lihavuus ei pelkästään lisää syövän riskiä
Lihavuus myös edistää syövän nopeampaa ja aggressiivisempaa leviämistä muihin kehon osiin, kuten keuhkoihin. Lihavuuden aiheuttamat biologiset muutokset, kuten lisääntynyt leptiinin määrä, syöpäsolujen liikkuminen ja immuunijärjestelmän häiriöt, luovat kasvualustan syöpäsolujen leviämiselle ja uusien pesäkkeiden syntymiselle.
Kun jaoin Villen postauksen omilla kommenteillani stooreihini IG:ssä korostin myös sitä, että leptiinin vaikutukset rintasyövässä tulisi huomioida. Tämä on yksi syy siihen, miksi olenkin tutkinut leptiiniä ja leptiiniresistenssiä sekä tuonut omiin valmennukseeni elementtejä, jolla leptiinhormonin toimintaa kehossa voi parantaa.
Siksi vuonna 2023 FBF 2.0 valmennukseeni tuli oma Leptin Reset osio ja julkaisin 2024 Leptin Fix valmennuksen. Koska ylipainon lisäksi leptiiniresistenssi on myös osasyy vakavempiin terveysongelmiin, kuten kohta opit miten se liittyy rintasyöpään.
Asia ei kuitenkaan ole yksinkertainen
Lihavuus ja syöpä ovat monimutkaisia ilmiöitä, joissa yhdistyvät genetiikka, ympäristötekijät ja elämäntavat, joita ei vielä täysin kaikkia ymmärretä, ainakaan tieteessä. Lihavuuden ja syövän välinen yhteys on siksi erittäin monimutkainen. Vaikka tämä suhde on monitahoinen, useita mekanismeja, jotka yhdistävät lihavuuden ja syövän, on tunnistettu. Sitä ei pidä vähätellä, että ylipainoisia suomessa on arviolta 2,9 miljoonaa, joista lihavia on 1,2 miljoonaa. Nyt puhutaan jo siis YLI puolesta suomalaisista, jotka ovat riskialttiita sairastua vakavasti!!!
Valkoisen rasvakudoksen (WAT) määrän lisääntyminen on nousemassa keskeiseksi tekijäksi kasvainten biologiassa sekä aineenvaihdunnan ja tulehduksellisten häiriöiden yhteydessä lihavuuteen. WAT koostuu kypsistä rasvasoluista, esirasvasoluista, endoteelisoluista, fibroblasteista, perisyyteistä ja immuunisoluista.
Lihavuus edistää myös hyperleptinemiaa, joka on epänormaalisti toimivan rasvakudoksen aiheuttama tila ja voi lisätä tulehdussytokiinien eritystä. Hyperleptinemia tarkoittaa leptiinin liika eritystä rasvakudoksesta. Tämä on yksi leptiiniresistenssin oire.
Esimerkiksi munuaissolukarsinooman hiirimallissa hyperleptinemian on havaittu vähentävän immunoterapian tehoa. Toisin sanoen, jos leptiiniä erittyy liikaa, lääketieteen hoidot eivät välttämättä tehoa.
Mitä lihoessa tapahtuu?
Kun ihminen lihoo, rasvasolut kasvavat ja niitä muodostuu lisää. Tämä ei ole pelkästään rasvan varastointia, vaan tapahtuu muitakin muutoksia:
Immuunisolut tunkeutuvat rasvakudokseen: Kun rasvasolut kasvavat liian suuriksi, ne alkavat lähettää tulehdusta aiheuttavia signaaleja. Tämän seurauksena elimistö lähettää immuunisoluja (esimerkiksi makrofageja) rasvakudokseen torjumaan tätä ongelmaa. Tämä johtaa krooniseen tulehdustilaan, joka ei kuitenkaan ratkaise itse rasvakudoksen ongelmia, vaan lisää ongelmia elimistössä.
Hypertrofisen rasvakudoksen uudelleenmuodostuminen: Rasvasolut voivat kasvaa niin suuriksi, että niiden rakenne alkaa muuttua. Tämä aiheuttaa häiriöitä rasvakudoksen toiminnassa, kuten huonontuneen kyvyn käsitellä ravintoaineita ja säätää energia-aineenvaihduntaa.
Verisuonten muodostuminen (angiogeneesi): Kun rasvakudos kasvaa, se tarvitsee lisää verta ja happea. Tämä johtaa uusien verisuonten muodostumiseen rasvakudoksen ympärille. Jos verisuonia ei muodostu riittävästi, osa rasvasoluista voi alkaa kuolla.
Rasvasolujen nekroosi: Rasvasolujen kuolema eli nekroosi voi tapahtua, kun ne kasvavat liian suuriksi tai eivät saa tarpeeksi happea (Hypoksi). Tämä prosessi aiheuttaa tulehdusta, mikä puolestaan voi lisätä kroonista tulehdustilaa kehossa.
Rasvahappojen epäsäännöllinen aineenvaihdunta: Kun rasvasolut hajoavat (lipolyysi), ne vapauttavat rasvahappoja verenkiertoon. Lihavuuden aikana tämä prosessi on hallitsematonta ja rasvahappojen määrä kasvaa liikaa. Tämä voi aiheuttaa ongelmia elimistössä, kuten insuliiniresistenssiä ja hormonaalisia häiriöitä.
Käytännössä tämä tarkoittaa, että lihavuuden aikana kehon rasvakudos muuttuu ja aiheuttaa tulehdusta, hormonaalisia häiriöitä ja aineenvaihdunnan muutoksia, jotka voivat edistää syövän kasvua ja leviämistä.
Kuten huomaat, läski ei ole vain läskiä!
Jatketaan, koita pysyä perässä.
Kun rasvasolut kasvavat nopeasti (adiposyytit eli rasvasolut suurenevat) rasvakudoksen laajentuessa, verisuonten muodostuminen (angiogeneesi) ei välttämättä pysy mukana, mikä johtaa hapenpuutteeseen eli hypoksiaan rasvakudoksessa.
Hypoksian seurauksena aktivoituu transkriptiotekijä nimeltä hypoksiasta indusoituva tekijä 1 (HIF-1), joka estää esirasvasolujen erilaistumista ja aloittaa rasvakudoksen fibroosin, eli sidekudosmuodostuksen.
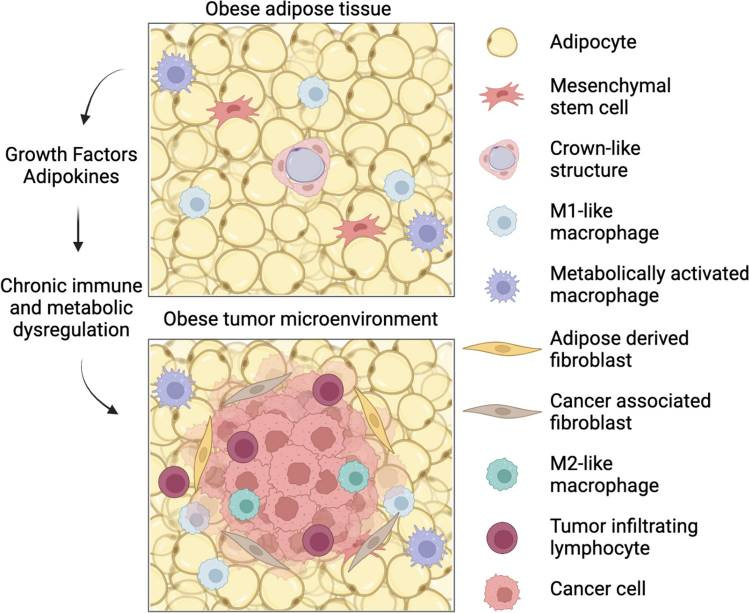
Rasvakudoksen makrofagit ympäröivät kuolleita tai vaurioituneita rasvasoluja ja muodostavat erillisiä rakenteita (CLS= Crown like Structure), mikä on keskeinen tekijä tulehduksellisessa prosessissa rasvakudoksessa.
Stressaantunut rasvakudos, yhdessä hypoksian kanssa, houkuttelee immuunisoluja kudokseen ja saa aikaan tulehdusta edistävien sytokiinien ja kemokiinien vapautumisen paikallisista makrofageista.
Tulehduksellisten signaalien lisäksi rasvasolut ja niiden esiasteet, mesenkymaaliset kantasolut (MSC), tukevat rintasyövän etenemistä tarjoamalla kriittisiä solupopulaatioita kasvainympäristöön (TME).
Syöpäsolut voivat muokata kasvainalueen läheisiä rasvasoluja ja niiden erittämiä tulehduksellisia molekyylejä, mikä edistää syöpään liittyvien rasvasolujen muodostumista. Nämä syöpään liittyvät rasvasolut vapauttavat vapaita rasvahappoja (FFA= Free Fatty Acids) kasvainympäristöön , lisäävät rasvakudoksen jäykkyyttä ja erittävät sytokiineja, kuten interleukiini (IL)-6, interleukiini (IL)-8, monosyyttejä houkutteleva proteiini (MCP)-1 ja kasvainekroositekijä alfa (TNFα), jotka edistävät tulehdusta.
Syöpään liittyvät rasvasolut eivät vain tue syöpäsolujen migraatiota ja leviämistä, vaan ne voivat myös muuttua fibroblasteiksi, jotka edistävät kasvaimen tunkeutumista muihin kudoksiin. Nämä rasvasoluista peräisin olevat fibroblastit, yhdessä metalloproteinaasien (entsyymit, jotka hajottavat soluväliaineita) kanssa, muokkaavat soluväliaineita ja edistävät tulehdusta sekä kasvaimen leviämistä. Syöpään liittyvät fibroblastit ovat avainasemassa kasvaimen kehittymisessä, sen leviämisessä ja syöpähoitojen toimivuudessa.
Rasvakudos, vaihdevuodet ja rintasyöpä
Valkoinen rasvakudos (WAT) ja adipokiinit (rasvakudoksen erittämät hormonit ja sytokiinit) liittyvät läheisesti lihavuuden ja syövän yhteyteen. Korkeat sisäisesti tuotettujen sukupuolihormonien tasot liittyvät lihavuuteen ja ovat yhteydessä rintasyövän riskiin erityisesti vaihdevuodet ohittaneilla naisilla.
Vaihdevuosien jälkeen estrogeenin tuotanto tapahtuu pääasiassa rasvakudoksessa, koska aromataasi-entsyymin aktiivisuus lisääntyy, mikä ei enää noudata normaalia kuukautiskiertoa. Tämä estrogeenin tuotanto on korostunut lihavilla naisilla, mikä pahentaa tilannetta.
Lihavuus ei ainoastaan lisää estrogeenin tuotantoa vaihdevuosien jälkeen, vaan myös lisää sen biologista saatavuutta vähentämällä sukupuolihormoneja sitovan globuliinin (SHBG) määrää. Tämä tarkoittaa, että elimistössä on enemmän vapaata estrogeenia, joka voi vaikuttaa suoraan kudoksiin ja kasvattaa rintasyövän riskiä. Mietithän kahdesti, haluatko ylipainoisena käyttää estrogeenivalmisteita?
Lisäksi lihavuuden aiheuttamat kohonneet tulehdusta edistävien sytokiinien, kuten kasvainekroositekijä-alfa (TNFα) ja interleukiini-6 (IL-6), tasot edistävät estrogeenin synteesiä lisäämällä aromataasin ilmentymistä. Tämä mekanismi vahvistaa edelleen estrogeenin tuotantoa, mikä voi lisätä syöpäriskiä ja syövän kasvua vaihdevuosi-iän ohittaneilla naisilla.
WAT-kudoksen erittämät adipokiinit
Valkoinen rasvakudos (WAT) toimii tärkeänä endokriinisena elimenä, joka erittää hormoneja, kasvutekijöitä, entsyymejä ja metaboliitteja.
WAT:in erittämä aine eli ns. sekretoomi, on keskeinen tekijä lihavuuden aiheuttamassa kasvaimen pahenemisessa. WAT:in erittämät adipokiinit ovat biologisesti aktiivisia polypeptidejä, joilla on laaja vaikutusvalta hormonitoimintaan, aineenvaihduntaan ja tulehdusreaktioihin. Koska rintasyövän kasvainmikroympäristössä rasvasolut ja kasvainsolut ovat tiiviissä vuorovaikutuksessa, adipokiineillä on keskeinen rooli rintasyövän solujen lisääntymiskyvyssä ja invasiivisuudessa, eli niiden kyvyssä levitä.
Leptiini:
Tämä adipokiini osallistuu solujen kasvuun ja tulehduksen säätelyyn, ja sen määrä on usein koholla lihavilla ihmisillä. Leptiini voi edistää syöpäsolujen kasvua ja leviämistä. Leptiini on rasvasolujen (adiposyytit) tuottama polypeptidihormoni, jonka määrä elimistössä kasvaa suhteessa rasvakudoksen määrään. Leptiinitasot ovat korkeammat rintasyöpäpotilailla verrattuna terveisiin, erityisesti ylipainoisilla tai lihavilla naisilla. Meta-analyysi, johon osallistui yli 13,500 naista 46 eri tutkimuksesta, osoitti, että kohonneet leptiinipitoisuudet liittyvät suurempaan rintasyöpäriskiin, keskimääräisellä erotuksella 0,96.
Leptiini vaikuttaa rintasyövän biologiaan monien mekanismien kautta, jotka lisäävät kasvaimen kokoa ja metastaasien (etäpesäkkeiden) määrää, sekä esikliinisissä että kliinisissä rintasyöpämalleissa, mukaan lukien kolminkertaisesti negatiivinen rintasyöpä (TNBC). Leptiini aktivoi PI3K/Akt-reitin, joka häiritsee rintakudoksen epiteelisolujen normaalia rakennetta ja edistää esisyöpäisten leesioiden kehittymistä.
Erityisesti TNBC:n korkea reaktiivisten happilajien (ROS) tuotanto, joka liittyy matalampaan antioksidanttitasoon, luo suotuisan ympäristön kasvaimen kasvulle, selviytymiselle ja tulehdukselle leptiinin läsnä ollessa. TNBC potilasperäisessä xenograft-mallissa (eläinmalli, jossa käytetään ihmisen kasvainta), lihavuuden muokkaamat rasvakudoksen kantasolut tuottivat leptiiniä, mikä johti prometastaattiseen fenotyyppiin, eli kasvain sai enemmän kykyä levitä, etenkin EMT liittyvien geenien lisääntyneen säätelyn kautta (EMT eli epiteelisolujen muuttuminen invasiivisiksi). Ruokavalion aiheuttamissa lihavissa hiirissä leptiinisignaalin lisääntyminen rikastutti kasvaimessa syöpäkantasoluja ja edisti solujen elinkykyä, migraatiota (liikkumista) ja invaasiota (tunkeutumista) kolminkertaisesti negatiivisissa rintasyöpäsoluissa.
Tämä tieto auttaa sinua ymmärtämään, kuinka tärkeä rooli lihavuudella ja sen seurauksena kohonneella leptiinitasolla on rintasyövän etenemisessä ja mahdollisesti sen hoitoresistenssissä. Painonhallintaan ja leptiiniin toimintaan kohdistuvat strategiat voisivat olla tärkeitä toimia rintasyövän ehkäisyssä ja hoidossa ja siksi kannustankin kaikkia parantamaan omaa leptiinisensitiivisyyttä ja vähentämään valkoista rasvakudosta kehosta. Vieläkö ajattelet minun tekevän jotain rikollista?
Mikä leptiiniresistenssi?
Tähän väliin, kerron lyhyesti mikä on leptiiniresistenssi: Se on tila, jossa rasvakudoksen erittämä leptiini ei pääse aivoissa sijaitseviin leptiinireseptoreihin kertomaan kehon energeettisestä tilasta, eli varastoituneesta rasvakudoksesta. Aivot eivät tiedä rasvavarastoistasi ja kuvittelevat, sinun kärsivän päinvastaisesta tilasta, nälänhädästä. Tämän johdosta leptiiniä erittyy ja erittyy, mutta se ei koskaan pääse minne sen kuuluisi mennä. Aivosi ohjailevat kehosi varastointi tilaan ja lihominen tapahtuu. Vaikka söisit kuinka vähän.
TNFα edistää leptiinin eritystä rasvasoluista
TNFα on sytokiini, jota erittyy erityisesti ihonalaisesta rasvakudoksesta (ja vähäisemmässä määrin sisäelinrasvakudoksesta) sekä esirasvasoluista. Terveessä rintakudoksessa TNFα edistää solujen lisääntymistä ja morfologista haarautumista, joka on osa rintarauhaskudoksen normaalia toimintaa. TNFα on keskeinen tulehdusta edistävä sytokiini, jota erittävät myös monosyytit ja makrofagit, ja lihavilla ihmisillä TNFα-tasot rasvakudoksessa nousevat 2,5-kertaisiksi, mikä liittyy vahvasti hyperinsulinemiaan (insuliinin liikaeritys). (Luethan kirjoitukseni 2-tyypin diabeteksesta ja sen todellisesta syystä)
TNFα edistää leptiinin eritystä rasvasoluista ja vähentää anti-inflammatorisen adipokiinin, adiponektiinin, määrää. Lisäksi TNFα lisää estrogeenin synteesiä indusoimalla aromataasin ja interleukiini-6 (IL-6) ilmentymistä rasvakudoksessa. TNFα edistää myös kolminkertaisesti negatiivisen rintasyövän (TNBC) solujen liikkumista ja käynnistää epiteelisolujen muuttumisen mesenkymaalisiksi (EMT), mikä tekee syöpäsoluista invasiivisempia. Tämä prosessi liittyy matalaan klaudiini-ilmentymään, mikä on ominaisuus, joka yhdistää TNFα:n syövän leviämiseen.
Selvennetään miten lihavuus muuttaa kehon immuunisolujen toimintaa ja koostumusta rasvakudoksessa, jotta pysyt mukana mitä tämä tarkoittaa rintasyövän ja muiden aineenvaihdunta sairauksien kontekstissa. Lihavuus muuttaa kehon immuunisolujen toimintaa ja koostumusta rasvakudoksessa.
Immuunisolujen määrä ja tyyppi muuttuvat: Lihavuuden aikana rasvakudokseen kertyy enemmän tulehdusta edistäviä immuunisoluja, kuten makrofageja, T-soluja ja neutrofiilejä. Näiden solujen määrä kasvaa suhteessa anti-inflammatorisiin soluihin, mikä aiheuttaa kroonisen matala-asteisen tulehduksen.
Tulehdukselliset sytokiinit lisääntyvät: Rasvakudos alkaa erittää enemmän tulehduksellisia sytokiineja, kuten TNFα, IL-6 ja MCP-1. Nämä sytokiinit edistävät tulehdusta koko kehossa ja vaikuttavat haitallisesti aineenvaihduntaan, esimerkiksi aiheuttamalla insuliiniresistenssiä.
Makrofagien toiminnan muutos: Lihavuuden aikana makrofagit, jotka normaalisti auttavat poistamaan kuolleita soluja ja estävät tulehduksia, muuttuvat tulehdusta edistäviksi. Ne alkavat ympäröidä vaurioituneita rasvasoluja ja vapauttavat lisää tulehdusta aiheuttavia signaaleja.
Immuunivasteen heikentyminen: Vaikka immuunijärjestelmä on aktivoitunut ja tulehdusta on paljon, lihavuus voi heikentää kehon kykyä torjua infektioita ja kasvaimia. Tämä johtuu siitä, että immuunijärjestelmän tasapaino on häiriintynyt ja se on jatkuvasti "ylikierroksilla".
Leptiini vaikuttaa merkittävästi immuunijärjestelmän toimintaan
Leptiini vaikuttaa erityisesti T-soluihin, jotka ovat tärkeä osa kehon puolustusjärjestelmää. Leptiinin reseptoreita on runsaasti aktivoiduissa T-soluissa, ja niiden läsnäolo vaikuttaa solujen kykyyn reagoida ravinnon saatavuuteen. Lihavuuden yhteydessä leptiini liittyy lisääntyneeseen T-solujen toimintahäiriöön ja PD-1 (ohjelmoitu solukuolema -reseptori 1) ilmentymiseen, mikä heikentää immuunivastetta.
Lihavuuden aikana leptiini aktivoi STAT3-signaalireitin CD8 + T-soluissa, mikä ohjaa solujen aineenvaihduntaa. Tämä johtaa rasvahappojen β-hapetuksen lisääntymiseen ja glykolyysin (glukoosista saatavan energian tuotannon) estymiseen, kuten havaittu kolminkertaisesti negatiivisen rintasyövän (TNBC) mallissa, jossa hiiret ruokittiin rasvaisella ruokavaliolla (koe eläinten ruokavalion rasva on usein soijaöljyä tai muita kasvi-siemenöljyjä, eikä juuri koskaan saturoitua rasvaa).
TNBC-kasvaimissa lihavilla potilailla havaittiin korkeampi leptiinin, CXCR4 ja CCR9(CXCL12 ja CCL25 reseptorit) ilmentyminen, mikä oli yhteydessä matalampaan CD8 + T-solujen tunkeutumiseen kasvaimeen verrattuna normaalipainoisiin potilaisiin. Tämä on merkittävä havainto, koska CD8 + T-solut ovat kriittisiä syövän torjunnassa.
Lihavuus lisää myös FasL + granulosyyttisten myeloidisten suppressorisolujen (MDSC) määrää leptiinin signaaloinnin kautta, mikä johtaa CD8 + T-solujen apoptoosiin (ohjelmoituun solukuolemaan) ja tekee syövästä vastustuskykyisemmän immunoterapialle.
Ymmärrän tekstin olevan monimutkaisen kuuloista, sillä se on suoraan tieteellisestä tutkimuksesta suomennettu. Mutta käytännössä se tarkoittaa:
Leptiini, jonka pitoisuudet ovat korkeammat lihavilla, vaikuttaa suoraan immuunijärjestelmän T-solujen toimintaan, vähentäen niiden kykyä torjua syöpäsoluja.
Lihavuuden yhteydessä TNBC-kasvaimet ilmentävät enemmän leptiiniin liittyviä reseptoreita ja molekyylejä, jotka vähentävät T-solujen tunkeutumista kasvaimeen, mikä heikentää kehon luonnollista immuunivastetta.
Lihavuus lisää myös syöpäsolujen kykyä vastustaa immunoterapiaa, mikä vaikeuttaa hoitoa ja heikentää ennustetta syöpäpotilailla.
Tämä osoittaa, kuinka merkittävä vaikutus lihavuudella on syöpähoidon tehokkuuteen ja immuunijärjestelmän toimintaan.
Voiko ruokavaliohoidolla vaikuttaa rintasyöpään?
Kyllä voi! Eikä tämäkään ole omaa päätelmääni, vaan ihan tieteessä todistettua. Se, ettei tätä interventiota suosita enemmän, pöyristyttää minua. On vahvaa tieteellistä näyttöä ruokavaliointervenioiden tehosta, taistelussa syöpää vastaan ja sen ehkäisyssä.
Miksi siitä ei saisi puhua?
Ruokavaliointerventiot tarjoavat paitsi kustannustehokkaan eli edullisen ja terveydenhuoltoa kuorimittamattoman ja vaikuttavan tavan säädellä kasvaimen tarvitsemia ravinteita. Tämä voi parantaa nykyisten hoitojen tehoa, aktivoida kehon luonnollisia syövänvastaisia mekanismeja ja kohdistaa syöpäsoluihin erityisiä haittavaikutuksia hyödyntämällä niiden aineenvaihdunnan erityispiirteitä, jotka eroavat terveistä soluista.
Yksi asia on tietysti se, että ruokavaliot ja muut luonnolliset hoitokeinot syöpiä vastaan eivät ole patentoitavissa tai pilleröitävissä, jolloin syöpien hoidosssa käytettävien lääke ja leikkaushoitojen tarve voisi vähetä ja vähemmän rahulia kilahtaa lääketeollisuuden kassaan. Se on minusta rikollista..
Ruokavalioilla voi myös olla syöpähoitojen haittavaikutuksia vähentäviä vaikutuksia ja esimerkiksi paasto-strategioilla voidaan vaikuttaa perinteisten hoitomenetelmien tehokkuuteen. Onkohan onkologisi muistanut kertoa sinulle tästä?
Mitkä ruokavalio ja paasto-strategiat toimivat parhaiten?
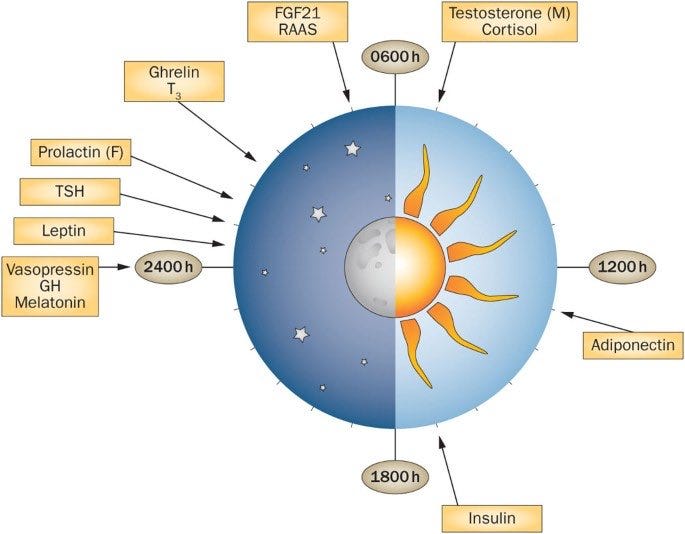
Aikaikkunaan rajattu syöminen (Time-Restricted Feeding, TRF) tarkoittaa syömisen ajoittamista 8–16 tunnin ajanjaksolle vuorokauden sisällä, sen sijaan että rajoitettaisiin kaloreita.
Tämä tapa ruokailla noudattaa elimistön vuorokausirytmiä ja on kasvattanut suosiotaan sekä tieteellisissä tutkimuksissa että kulttuurissa. Vuorokausirytmin komponentit ovat yhteydessä ravintoa aistiviin reitteihin, joten epäsäännölliset ruokailutavat ja ylensyönti voivat häiritä hormonitoiminnan ja ravintoaineiden aineenvaihdunnan vuorokausirytmiä. Rajoittamalla ilta-aikaan tapahtuvaa syömistä ja välttämällä yöllä syömistä, TRF yhdistää ateria-ajat optimaalisesti hormonivasteen kanssa. Huom! Aikarajoitteinen syöminen ei ole sama asia kuin perinteinen pätkäpaasto, jossa aamiainen jätetään välistä.
Hiirimallissa, jossa tutkittiin vaihdevuosien jälkeistä lihavuutta, TRF vähensi kehon painoa, paransi glukoosinsietoa ja insuliiniresistenssiä sekä vähensi maksan rasvakertymiä. Nämä havainnot vahvistettiin kahdeksan viikon kliinisessä tutkimuksessa, jossa ylipainoiset ja lihavat osallistujat noudattivat 10 tunnin syömisikkunaa. Tuloksena oli merkittävä painonlasku ja parantuneet paastoverensokeriarvot. Yksi syy, miksi FBF valmennuksessa painotetaan nimenomaan vuorokausirytmin mukaista syömistä, on nimenomaan se, että sen avulla voidaan korjata vuorokausirytmiä.
Tutkimukset osoittavat yhä enemmän, että vuorokausirytmi vaikuttaa syövän syntyyn, ja krooniset vuorokausirytminhäiriöt voivat lisätä rintasyövän etäpesäkkeiden riskiä .
Kuinka shokeeraavaa, jos siis kukut ja syöt öisin ja katsot Tiktokkia, voit lihavuuden ja leptiiniresisnssin lisäksi lisätä riskiäsi sairastua rintasyöpään ja pahentaa etäpesäkkeiden muodostumista. Kerrothan, jos lääkärisi on kehottanut sinua tarkkailemaan ruutuaikaasi tai ajoittamaan ruokailusi vuorokausirytmin mukaisesti!!
Tuskin, mutta todella toivon että sellaisiakin lääkäreitä pian löytyisi.
Kerron vielä tähän mitä minun valmennuksessani oikein tehdään. Varmasti sallinette minun kertoa, mitä teen työkseni. Etenkin jos tänne loppuun asti olet tätä kirjoitusta lukenut ja kenties oppinut siitä jotain, ihan ilmaiseksi.
Suosituimpia valmennuksiani on tähän mennessä ollut FBF-valmennus. Olen viimeiset kahdeksan vuoden aikana auttanut yli 35 000 ihmistä terveemmäksi erilaisten ruokavalio ja elämäntapa strategioiden avulla.
FBF-valmennuksessani tärkeimpinä asioina joita opetan ja autan, on kokonaisvaltaisen hyvinvoinnin lisääminen ruokavalion, ruokailun oikein ajoittamisen sekä valoympäristön huomioimisen avulla. Monet tulevat sinne laihtumaan, toiset taas hakemaan parempaa terveyttä.
Toinen suosittu valmennukseni Leptin Fix auttaa eroon leptiiniresistenssistä ja leptiinin liika-erityksestä. Leptiiniresistenssi on ylipainon, lihavuuden ja kuten huomaat jopa rintasyövän taustalla vaikuttava tekijä ja jopa juurisyy. FBF valmennuksesta löytyy myös oma leptin reset osio.
Yksi tärkein asia kuitenkin on, mitä valmennuksissani tehdään on vuorokausirytmin häiriön korjaaminen. Se aiheuttaa myös leptiiniresistenssiä, ylipainoa ja lihavuutta. Kehomme on ohjelmoitu toimimaan luonnon valo-ja pimeä kierron mukaisesti, hormoneitamme myöten. Nyky-ihminen ei osaa erottaa päivää yöstä, eikä kesää talvesta ja se näkyy terveydessämme.
FBF LIFE:stä löytyvät molemmat valmennukset ja paljon muuta vain n. 17€/kk Pieni hinta suuresta mahdollisuudesta lisätä elinvoimaa ja terveyttä elämääsi.
Tässäkään kirjoituksessa aivan kuten en valmennuksissanikaan väitä, että kukaan voisi parantua mistään sairaudesta oppieni (jotka ovat ihan tieteessä todistettuja eikä mitään huuhaata) avulla. Näinkin voi tosin käydä ja on käynytkin useasti.
Pohjimmainen haluni on herättää ihmisen oma uteliaisuus omaa terveyttä ja elämää kohtaan.
Mitä jos asiat eivät olekkaan niin mustavalkoisia kuin meille väitetään ja mitä jos sinä itse voitkin vaikuttaa siihen miten terveenä ja elinvoimaisena voit elää kun syöt lajinmukaisesti ja pyrit kunnioittamaan elintavoillasi luonnon syklejä joissa sinunkin kuuluu olla osana.
Liity mukaan FBF Heimoon ja katso itse mitä voit omalle hyvinvoinnillesi tehdä.
Klikkaamalla : FBF LIFE
Lähteet ja lisää luettavaa aiheesta. (Huomaathan että osa linkeistä on upotettu tekstiin. )
Bhardwaj P, et al. Estrogens and breast cancer: Mechanisms involved in obesity-related development, growth and progression. The Journal of Steroid Biochemistry and Molecular Biology. 2019;189:161–170. doi: 10.1016/j.jsbmb.2019.03.002.
Lohmann AE, et al. Association of obesity with breast cancer outcome in relation to cancer subtypes: A meta-analysis. jnci: Journal of the National Cancer Institute. 2021;113(11):1465–1475. doi: 10.1093/jnci/djab023.
Chen Y, et al. Body mass index had different effects on premenopausal and postmenopausal breast cancer risks: A dose-response meta-analysis with 3,318,796 subjects from 31 cohort studies. BMC Public Health. 2017;17(1):936. doi: 10.1186/s12889-017-4953-9.
White AJ, et al. Overall and central adiposity and breast cancer risk in the Sister Study. Cancer. 2015;121(20):3700–3708. doi: 10.1002/cncr.29552.
Neuhouser ML, et al. Overweight, obesity, and postmenopausal invasive breast cancer risk. JAMA Oncology. 2015;1(5):611. doi: 10.1001/jamaoncol.2015.1546.
Widschwendter, P., et al. (2015). The influence of obesity on survival in early, high-risk breast cancer: Results from the randomized SUCCESS A trial.Breast Cancer Research, 17(1), 129.
Mazzarella L, et al. Obesity increases the incidence of distant metastases in oestrogen receptor-negative human epidermal growth factor receptor 2-positive breast cancer patients. European Journal of Cancer. 2013;49(17):3588–3597. doi: 10.1016/j.ejca.2013.07.016.
Shu X, et al. Associations of obesity and circulating insulin and glucose with breast cancer risk: A Mendelian randomization analysis. International Journal of Epidemiology. 2019;48(3):795–806. doi: 10.1093/ije/dyy201.
Zhao C, et al. Current landscape: The Mechanism and therapeutic impact of obesity for breast cancer. Frontiers in Oncology. 2021;11:704893. doi: 10.3389/fonc.2021.704893.
Lee C, et al. Fasting cycles retard growth of tumors and sensitize a range of cancer cell types to chemotherapy. Science Translational Medicine. 2012;4(124):124ra27–124ra27. doi: 10.1126/scitranslmed.3003293.
Di Biase S, et al. Fasting-Mimicking diet reduces HO-1 to promote t cell-mediated tumor cytotoxicity. Cancer Cell. 2016;30(1):136–146. doi: 10.1016/j.ccell.2016.06.005.
de Groot S, et al. Fasting mimicking diet as an adjunct to neoadjuvant chemotherapy for breast cancer in the multicentre randomized phase 2 DIRECT trial. Nature Communications. 2020;11(1):3083. doi: 10.1038/s41467-020-16138-3.
Harvie MN, Howell T. Could intermittent energy restriction and intermittent fasting reduce rates of cancer in obese, overweight, and normal-weight subjects? A summary of evidence. Advances in Nutrition. 2016;7(4):690–705. doi: 10.3945/an.115.011767.
Kettner NM, et al. Circadian dysfunction induces leptin resistance in mice. Cell Metab. 2015;22:448–459.
Hadadi, E., et al. (2020). Chronic circadian disruption modulates breast cancer stemness and immune microenvironment to drive metastasis in mice.Nature Communications, 11(1), 3193. [PMC free article] [PubMed]
Lee Y. Roles of circadian clocks in cancer pathogenesis and treatment. Experimental & Molecular Medicine. 2021;53(10):1529–1538. doi: 10.1038/s12276-021-00681-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Sundaram S, Yan L. Time-restricted feeding mitigates high-fat diet-enhanced mammary tumorigenesis in MMTV-PyMT mice. Nutrition Research. 2018;59:72–79. doi: 10.1016/j.nutres.2018.07.014. [PubMed] [CrossRef] [Google Scholar]
Fabian CJ, et al. Favorable modulation of benign breast tissue and serum risk biomarkers is associated with > 10 % weight loss in postmenopausal women. Breast Cancer Research and Treatment. 2013;142(1):119–132. doi: 10.1007/s10549-013-2730-8.
Eckel-Mahan LK, et al. Reprogramming of the Circadian Clock by Nutritional Challenge. Cell. 2013;155(7):1464–1478. doi: 10.1016/j.cell.2013.11.034.
Zeb F, et al. Time-restricted feeding regulates molecular mechanisms with involvement of circadian rhythm to prevent metabolic diseases. Nutrition. 2021;89:111244. doi: 10.1016/j.nut.2021.111244.
Bauersfeld, S. P., et al. (2018). The effects of short-term fasting on quality of life and tolerance to chemotherapy in patients with breast and ovarian cancer: A randomized cross-over pilot study.BMC Cancer, 18(1), 476.
Cui H, López M, Rahmouni K. The cellular and molecular bases of leptin and ghrelin resistance in obesity. Nature Reviews Endocrinology. 2017;13(6):338–351. doi: 10.1038/nrendo.2016.222.
Schernhammer ES, et al. Rotating night shifts and risk of breast cancer in women participating in the nurses’ health study. JNCI J. Natl Cancer Inst. 2001;93:1563–1568. [PubMed] [Google Scholar]
Hansen J. Night shift work and risk of breast cancer. Curr. Environ. Health Rep. 2017;4:325–339.
Samuelsson LB, Bovbjerg DH, Roecklein KA, Hall MH. Sleep and circadian disruption and incident breast cancer risk: An evidence-based and theoretical review. Neurosci. Biobehav. Rev. 2018;84:35–48.
Mocellin S, Tropea S, Benna C, Rossi CR. Circadian pathway genetic variation and cancer risk: evidence from genome-wide association studies. BMC Med. 2018;16:20
Cadenas C, et al. Loss of circadian clock gene expression is associated with tumor progression in breast cancer. Cell Cycle. 2014;13:3282–3291.
Oike H, Sakurai M, Ippoushi K, Kobori M. Time-fixed feeding prevents obesity induced by chronic advances of light/dark cycles in mouse models of jet-lag/shift work. Biochem. Biophys. Res. Commun. 2015;465:556–561.









Kiitos tästä suorasukaisesta kannanotosta. On hienoa että joku jaksaa taistella tuulimyllyjä vastaan 🙏